CD34+造血干细胞是血液系统中的关键细胞,具有自我更新和多向分化潜能。通过转染技术,可以研究基因功能并开发新的治疗策略。ProteanFect Max作为一种高效的转染试剂,已被证明能显著提高mRNA转染效率,且对细胞分化影响较小。

2. 材料与方法
2.1 CD34+造血干细胞的分选
使用动员人单采血或脐带血,通过阳性选择分选试剂盒分离CD34+细胞。推荐使用Lymphoprep™(Stemcell, 07861)作为分离试剂,以及CD34 MicroBead Kit, human(Miltenyi Biotec, 130-046-702)进行细胞分选。
2.2 培养基的配制
-
SFEM II培养基(Stemcell, 09655)和StemSpan™ CC100(Stemcell, 02690)以99:1比例混合。
-
若添加抗生素,需稀释1000倍。
-
配制完成后,培养基应放置于4°C冰箱储存,并尽量在1个月内使用完。
2.3 细胞培养与传代
-
分选后的CD34+细胞以300g离心5分钟,用1 mL完全培养基重悬后计数。
-
根据计数结果,将细胞重悬至105 cells/mL的密度,接种到T25培养瓶或细胞培养板中。
-
3天后补液一次,若进行转染实验,需调整细胞密度至2×105 cells/mL,并隔天补液。
2.4 转染操作
-
转染核酸:mRNA。
-
转染培养基:使用Opti-MEM培养基或无血清RPMI 1640/无血清DMEM培养基。
-
转染体系:配置ProteanFect Max转染体系,具体protocol需参考私戳获取。
-
细胞准备:确保细胞活率超过90%,避免反复离心。
-
转染过程:孵育时间建议15分钟,适当延长可提高转染率,但可能影响细胞活力。
-
效率检测:使用阳性对照mRNA,转染后5-48小时内观察EGFP表达。细胞活率可通过镜下观察、台盼蓝、AO/PI染色或流式细胞术检测。
3. 结果
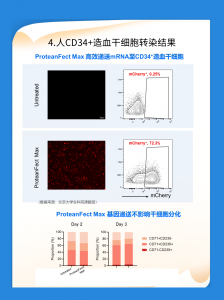
使用ProteanFect Max转染的CD34+造血干细胞显示出高达72.3%的mCherry+表达率,而未处理组仅为0.25%。此外,转染后细胞的分化状态未受显著影响,CD71+CD235-细胞比例在转染后第2天和第3天保持稳定。
华雅思创生物®专注于提供CGT、分子诊断和先进医疗的生物试剂和医疗耗材产品,我们的客户遍及细胞治疗、疫苗抗体、医疗诊断、脑科学、合成生物、长寿研究和医美保健等领域。”买试剂,找华雅”,华雅思创生物®凭借深厚的技术实力和严格的质量控制体系,已成为众多科研机构和生物制药企业的首选供应商。


